プロジェクト
【アデノシン三リン酸(ATP)の動的構造の電子状態シミュレーション(由良 敬・鷹野景子)】
アデノシン三リン酸(ATP)は、生物が生きていくためのエネルギー源です。
生物が摂取した糖の一部は、ATPに存在するリン酸の共有結合として蓄えられます。
生物は、必要なときにATPからγ位のリン酸基を切断することで、エネルギーを得ています。
ATPの合成と分解の化学反応は、タンパク質によって触媒されており、ATPの合成と分解は
水中では容易には起こらないことが知られています。
このことよりATPの三次元構造は、タンパク質と相互作用している場合と水中では大きく異なっていることが予想されます。
そこで本研究課題では、水中のATPとタンパク質と相互作用したATPの立体構造の違いが、
化学反応をすすめる上で必要であることを分子動力学計算と量子化学シミュレーションで明らかにすることを目的としました。
コンピュータシミュレーションによって、立体構造と電子状態の関係を調べることによって、ATP分解の化学反応において、
生物がタンパク質を利用している理由を明らかにすることができます。
成果1:タンパク質と相互作用するATPの構造データ収集
国際タンパク質立体構造データベース(PDB)に収納されているタンパク質座標データを、 ATP分子を中心にして整理収集したところ、ATPを含み(ATPとの複合体でタンパク質の構造解析がなされ)、 かつ明らかに共通祖先由来ではないタンパク質が総計210種類存在することがわかりました。 これらが本研究の解析対象となり得ます。
成果2:タンパク質と相互作用するATPの構造には特徴がある
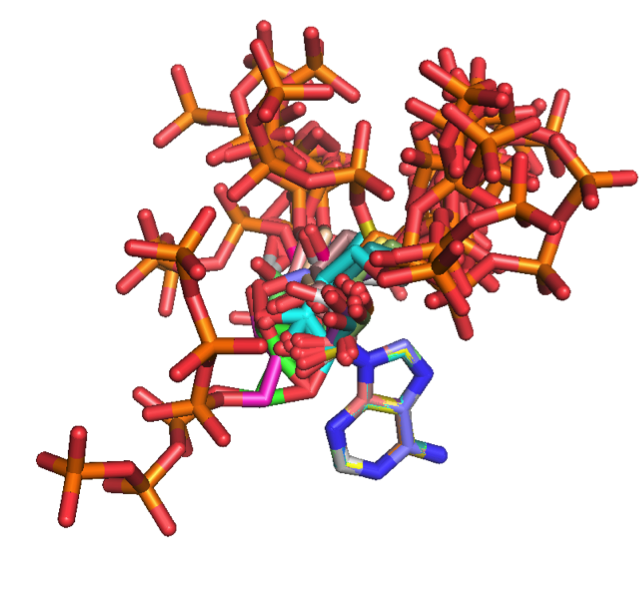 タンパク質と相互作用したATPの三次元構造210種類を比較したところ、右図のように3種類の構造に分類できることがわかりました。
タンパク質と相互作用したATPの三次元構造210種類を比較したところ、右図のように3種類の構造に分類できることがわかりました。
右図は21種類のATP分子の座標を変換し、すべてのATPのアデニン環(中央の5角形と6角形)が同一の座標になるようにした上で、
ATP分子全体を表示した結果です。
これによるとリン酸基(赤とオレンジ色)部分が右上、真上および左下に延びる3種類しかないことがわかります。
これらの構造がATPの固有の構造特性なのか、タンパク質と相互作用する際にATPに課せられた拘束条件なのかは、
ATP単体の水中における分子動力学計算で明らかにできるはずです。
成果3:水中におけるATPの分子動力学シミュレーション
 ATPの分子動力学計算を、分子動力学シミュレーションソフトウエアGROMACS 4.0.4を用いて行いました。
初期構造としてThermus thermophilus 由来のD-alanine:D-alanineリガーゼ(PDBコード:2zdq)に結合しているATPを用いました。
ATPの構造エネルギーを極小化した後に、1ステップが1フェムト秒の分子動力学計算を2ナノ秒間(2×106ステップ)連続して行うことができました。
分子動力学計算に必要な初期乱数を変えることで、この計算を10回実行することができました。
ATPの分子動力学計算を、分子動力学シミュレーションソフトウエアGROMACS 4.0.4を用いて行いました。
初期構造としてThermus thermophilus 由来のD-alanine:D-alanineリガーゼ(PDBコード:2zdq)に結合しているATPを用いました。
ATPの構造エネルギーを極小化した後に、1ステップが1フェムト秒の分子動力学計算を2ナノ秒間(2×106ステップ)連続して行うことができました。
分子動力学計算に必要な初期乱数を変えることで、この計算を10回実行することができました。
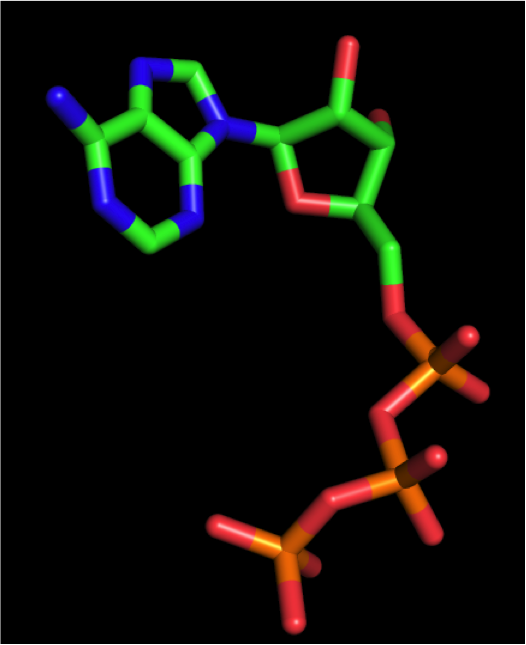
左図が分子動力学シミュレーション途中のスナップショット構造です。スナップショット構造は1ピコ秒毎に取得することができました。
分子動力学計算で得られたATPの構造とタンパク質との複合体で得られているATPの構造を比較すると、いくつかの結合回転角に顕著な違いがあることがわかりました。
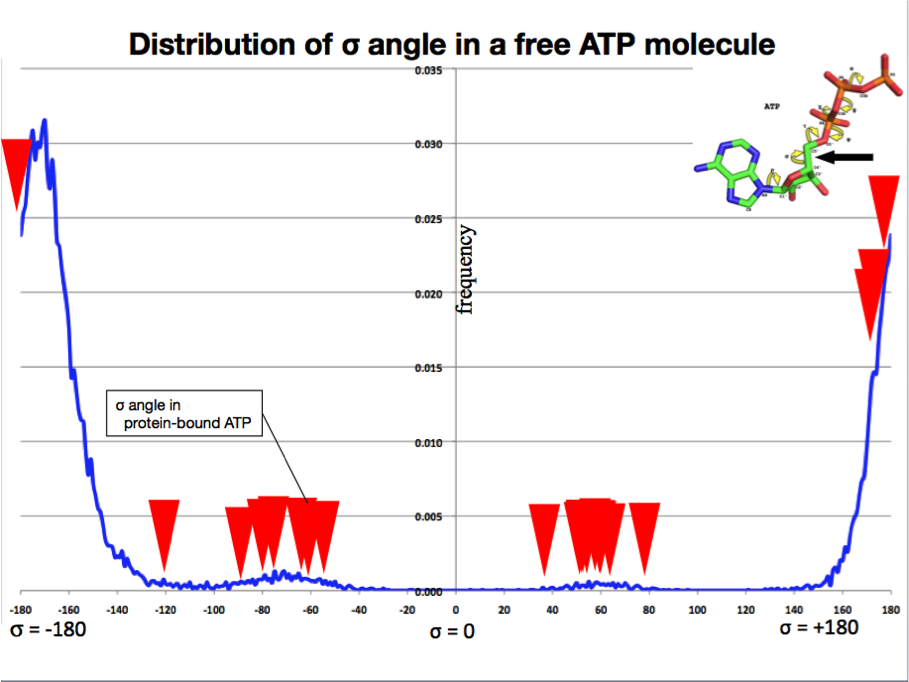
右図にはATPのリボースとリン酸基とを接続する化学結合のねじれ角を示しました。
分子動力学シミュレーションでは、このねじれ角はほとんどの時間帯でトランスの角度を(±180度)をとることが明らかになりました(図の青線)。
ところが、タンパク質と結合しているATPではトランス角の例が少なく、多くがゴーシュプラス(+60度)またはゴーシュマイナス(―60度)
付近に存在することがわかりました(図の赤くさび)。
これらの角度は、ATPの水中分子動力学シミュレーションでは、ほとんどあらわれない角度であることから、ATPがタンパク質に結合する際には、
何らかの構造的制約(無理)がかかっていることが示唆されました。
タンパク質に結合したATPは、多くの場合、γ位のリン酸基が切り落とされ(加水分解され)、その結果タンパク質が高エネルギーを得ます。
今回見つけたATPの独特の構造は、タンパク質がATPから高エネルギーを得るために必要な、ATPの特殊な構造の可能性があります。
成果4:ATPの量子状態計算
分子動力学シミュレーションにより2×104個のスナップショット構造を得ることができました。
これらの構造には、γ位のリン酸基が切れにくい(強く結合する)特徴があると推定されます(上記成果3)。
現在これらのスナップショット構造の量子状態を、量子化学計算ソフトウエアGaussianを用いて解析中です。
考察
今回の計算により、ATPがタンパク質と相互作用する際に、ATPが水中に存在するときにはほとんど見られない構造をとることがはじめてわかりました。 この構造的制約は、ATPが生体中のエネルギー源になっていることと何らかの関係があると考えられます。 その考えを支持するデータは、分子動力学シミュレーションによって得られたATPのスナップショット構造の量子状態計算によって得られると期待されます。